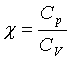Równanie przemiany ma postać (równanie Poissona)
Wykładnik potęgi (kappa)- wykładnik adiabaty, przyjmuje wartość:
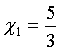 dla gazów jednoatomowych np.: He, Ar, Kr
dla gazów jednoatomowych np.: He, Ar, Kr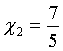 dla gazów o cząsteczkach dwuatomowych np.: O2, H2, CO
dla gazów o cząsteczkach dwuatomowych np.: O2, H2, CO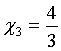 dla gazów o cząsteczkach trój lub więcej - atomowych, np.: H2O, CO2
dla gazów o cząsteczkach trój lub więcej - atomowych, np.: H2O, CO2Przemiana Adiabatyczna
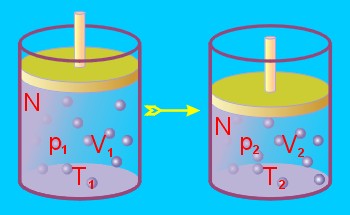 Wykresy przemiany adiabatycznej (adiabaty) w porównaniu z wykresami przemiany izotermicznej:
Wykresy przemiany adiabatycznej (adiabaty) w porównaniu z wykresami przemiany izotermicznej: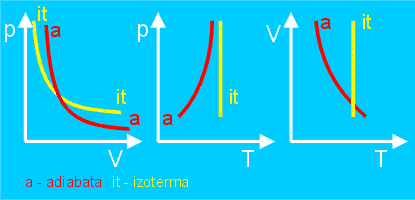 Ilość ciepła potrzebnego do ogrzania jednego kilograma substancji o jeden stopień to tzw. ciepło właściwe
Ilość ciepła potrzebnego do ogrzania jednego kilograma substancji o jeden stopień to tzw. ciepło właściwe 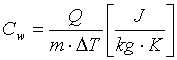
Ciepło molowe jest to ilość ciepła potrzebnego do ogrzania jednego mola substancji o jeden stopień
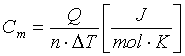
Ponieważ
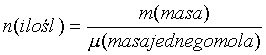 to
to Gazy mogą być ogrzewane w wyniku dostarczania ciepła tylko w przemianie izobarycznej (p = const.) i izochorycznej (V = const.). Ogrzanie 1 mola gazu o 1 K w obu przypadkach wymaga różnych ilości ciepła i dlatego ciepło molowe (i właściwe) przy stałym ciśnieniu (Cp) ma inną wartość niż ciepło molowe (i właściwe) przy stałej objętości (Cv). Związek między ciepłami molowymi ma postać Cp = Cv + R, gdzie R - to stała gazowa.
Iloraz Cp i Cv stanowi wykładnik adiabatyczny c, gdzie