 * dyfuzja śledzona (ang. tracer diffusion) to proces mikroskopowy polegający na chaotycznym ruchu pojedynczej ("śledzonej") cząsteczki (przykład: ruchy Browna).
* dyfuzja śledzona (ang. tracer diffusion) to proces mikroskopowy polegający na chaotycznym ruchu pojedynczej ("śledzonej") cząsteczki (przykład: ruchy Browna).* dyfuzja chemiczna to proces makroskopowy obejmujący makroskopowe ilości materii (lub energii), zwykle opisywany równaniem dyfuzji i prowadzący do wyrównywania stężenia (lub temperatury) każdej z dyfundujących substancji w całym układzie.
Podstawowymi prawami opisującymi dyfuzję są prawa Ficka. Pierwsze prawo Ficka stwierdza że:
strumień cząstek dyfuzji jest proporcjonalny do gradientu stężenia
 gdzie:
gdzie:J - strumień składnika (masa molowa składnika przepływająca przez jednostkowy przekrój w jednostce czasu),
D - współczynnik dyfuzji,
φ - stężenie [(ilość substancji) na jednostkę objętości],
x - współrzędna osi, wzdłuż której zachodzi dyfuzja.
Na rysunku poniżej przedstawiono sytuację, gdy na starcie dwa gazy są zlokalizowane w oddzielnych obszarach.
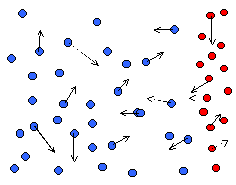
Oczywiste jest, że jeśli cząsteczki tych gazów chaotycznie poruszają się, zderzają, przekazują energię kinetyczną, to wkrótce nastąpi ich wymieszanie i powstanie sytuacja np. jak na rysunku poniżej.
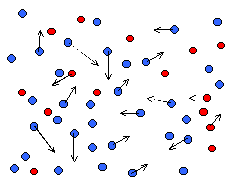
Co ciekawe, dyfuzja zachodzi nie tylko dla gazów i cieczy (co jest dość zrozumiałe, jako że cząsteczki w tych stanach skupienia wykonują intensywne ruchy chaotyczne), ale nawet i w ciałach stałych. Jednak w tym ostatnim przypadku jej tempo jest bardzo powolne.